炎症を司る分子STINGの活性化機構を完全解明
自己炎症性・神経変性疾患の新規治療戦略
2024年1月12日
国立大学法人東海国立大学機構 岐阜大学
炎症を司る分子STINGの活性化機構を完全解明
自己炎症性・神経変性疾患の新規治療戦略
【発表のポイント】
・STING(注1)経路は、DNAウイルス感染から身体を守る自然免疫経路の1つです。そのSTINGのトランスゴルジネットワーク(TGN)(注2)における活性化分子機構を解明しました。
・STINGがTGNでクラスター化すること、クラスター化がSTINGの活性化に必要なこと、クラスター化にパルミトイル脂質修飾(注3)とゴルジ体コレステロールが必要であることをまとめて明らかにしました。
・炎症性疾患・神経変性疾患の発症機序の理解、および治療薬の開発につながる成果であり、医学・薬学分野への展開が期待できます。
【概要】
自然免疫は、先天的に備わっている、異物に対する応答機構です。STINGタンパク質は、ヘルペスウイルスなどのDNAウイルスの感染に応答して自然免疫応答、炎症を誘導します。それによってSTING経路はDNAウイルス感染から身体を守っていますが、その一方で、異常な活性化は自己免疫疾患、神経変性疾患、がんなど多様な疾患を引き起こします。これまで、東北大学大学院生命科学研究科の見目悠大学院生、髙橋花乃子大学院生、向井康治朗助教、田口友彦教授および、東海国立大学機構岐阜大学糖鎖生命コア研究所の鈴木健一教授(国立がん研究センター研究所先端バイオイメージング研究分野分野長 併任)らの共同研究グループは、STINGの活性にはパルミトイル化脂質修飾が必要であることを明らかにしてきました。
今回、STINGは、パルミトイル化脂質修飾を介してTGNのコレステロールを含む脂質マイクロドメインで平均20分子以上のクラスターを形成すること、およびSTINGのクラスター形成が自然免疫シグナルの活性化に必要であることが明らかにしました。本研究成果により細胞内コレステロールレベルを制御することがこれら疾患を治療する新しい手段となると期待されます。
本研究成果は2024年1月11日に科学誌Nature Communicationsに掲載されました。
【詳細な説明】
研究の背景
自然免疫は、体内に侵入した病原体や異常になった自己の細胞をいち早く感知し、それを排除する仕組みであり、生体防御の最前線に位置しています。小胞体に局在する4回膜貫通タンパク質STINGは、DNAウイルスの感染により細胞質に出現したDNAに応答し、自然免疫応答を誘導します。最近、STING経路は、がん、自己炎症性疾患、老化性炎症、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症など多様な疾患の炎症病態に寄与することが報告され、非常に注目されています。
これまでに東北大学大学院生命科学研究科の向井助教・田口教授のグループは、DNAウイルス感染に伴ってSTINGが小胞体からゴルジ体へ移動することを見出しました。さらにゴルジ体でSTINGがパルミトイル化脂質修飾を受けることは、自然免疫応答の活性化に必要であることを明らかにしてきました(Mukai et al. Nat Commun 2016)。しかしながらパルミトイル化STINGがどのように自然免疫応答を活性化するのかは不明でした。
今回の取り組み
Ⅰ) 生細胞内におけるSTINGクラスターの存在証明
パルミトイル化脂質修飾を受けたタンパク質は、コレステロールに富む脂質マイクロドメイン内でクラスターを形成して機能を発揮すると考えられています。そこで、脂質マイクロドメイン内でパルミトイル化STINGがクラスター化することで、自然免疫応答を活性化するという仮説を立てました。本研究では、1分子レベルで細胞内分子の局在を観察できる超解像顕微鏡法PALM(注4)を用いて、STING分子の細胞内での動態を解析しました。その結果、STINGはTGNにおいて平均20分子以上のクラスターを形成することが判明しました(図2)。
Ⅱ) パルミトイル化およびコレステロール依存的なSTINGのクラスター形成
続いて、STINGのクラスター形成を制御する分子機構の解明に挑みました。まず、パルミトイル化脂質修飾がSTINGのクラスター形成に寄与するのか検討しました。STING特異的パルミトイル化阻害剤を用いて、STINGのパルミトイル化を阻害したところ、STINGのクラスター形成が有意に抑制されました(図3)。次にSTINGのクラスター形成における脂質マイクロドメインの必要性を検討しました。TGNへのコレステロール輸送を阻害したところ、STINGのクラスター形成が有意に抑制されました。この際、STING経路が自然免疫応答を活性化するために必要なキナーゼTBK1(注5)および転写因子IRF3(注6)のリン酸化も抑えられました(図3)。以上、STINGのクラスター形成はSTINGのパルミトイル脂質修飾およびコレステロールに依存していることが示されました。
Ⅲ) STINGクラスター形成依存的な自然免疫シグナルの活性化
STINGが自然免疫シグナルを活性化するためには、リン酸化酵素であるTBK1がSTING上に安定的に滞在し、STINGタンパク質などをリン酸化する必要があります。そこで、STINGのクラスター形成が、TBK1のSTING上での滞在時間に影響するのかを検証しました。その結果、STINGのクラスターが形成されない条件下では、TBK11分子あたりのSTING上での滞在時間が減少することがわかりました。
今後の展開
約四半世紀前、コレステロールに富む脂質マイクロドメインにパルミトイル化脂質修飾を受けたタンパク質が集積することでその機能を発揮するモデルが提唱されました(脂質ラフト仮説)(Simons et al. Nature 1997)。しかしながら、脂質ラフトに局在すると考えられているタンパク質を一分子レベルで観察することは難しく、これまで脂質ラフトの存在証明や機能解析は進んでいませんでした。今回、PALMを用いることで、STINGタンパク質がTGN上でクラスター(20分子以上)を形成することを発見しました。さらに、STINGのパルミトイル化脂質修飾やTGNへのコレステロール輸送を阻害すると、STINGクラスターが形成できず、自然免疫応答も顕著に抑制されることがわかりました。この結果は、パルミトイル化STINGがTGNのコレステロールに富む脂質ラフト上で集積し、その機能を発揮することを示しています。したがって、本研究成果は、細胞内における脂質ラフトの存在とその機能を直接的に証明するものであり、基礎生物学的に重要な発見です。(図1)。
STINGはウイルス由来の非自己DNAに応答して、自然免疫シグナルを誘導するタンパク質として発見されました。最近STING自然免疫応答は、がん免疫応答において重要な役割を果たすことや、老化、自己炎症性疾患、および神経変性疾患における炎症病態に寄与することが報告され、疾患治療のターゲットとして非常に注目されています。今回、TGNへのコレステロール輸送を阻害するとSTING自然免疫応答が顕著に抑制されることを示しました。したがって、本研究成果から、コレステロールレベルを減らすことは、STING炎症と関連する上記疾患を治療する新しい手段となることが期待されます。
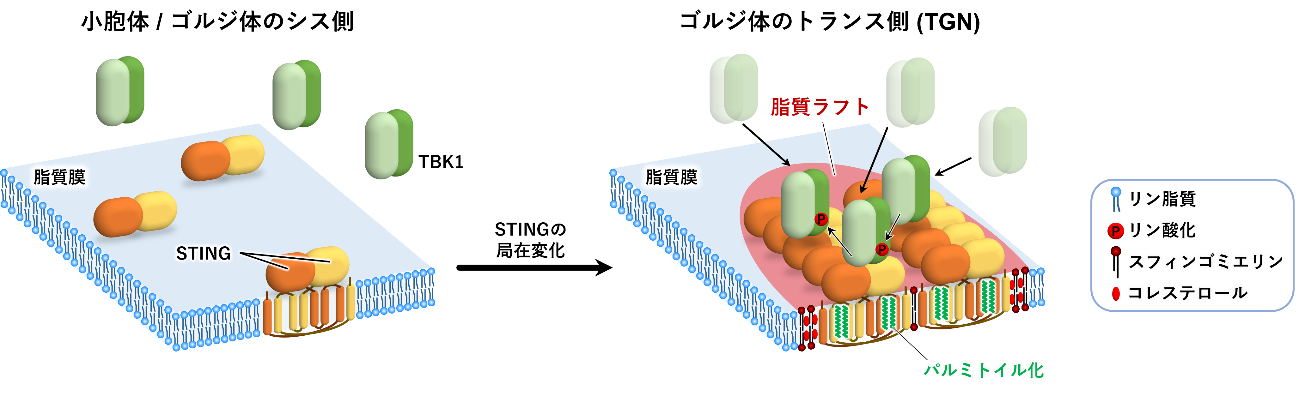
図1. 本研究の概要
小胞体もしくはゴルジ体のシス側に局在するSTINGはクラスターを形成しておらず、TBK1は細胞質に局在しています。一方、TGNに移行したSTINGはパルミトイル化脂質修飾依存的に脂質ラフト上でクラスターを形成します。その結果、TBK1が安定的にSTING上に局在できるようになり、TBK1が活性化します。活性化したTBK1がSTINGなどをリン参加することで自然免疫シグナルを活性化します。
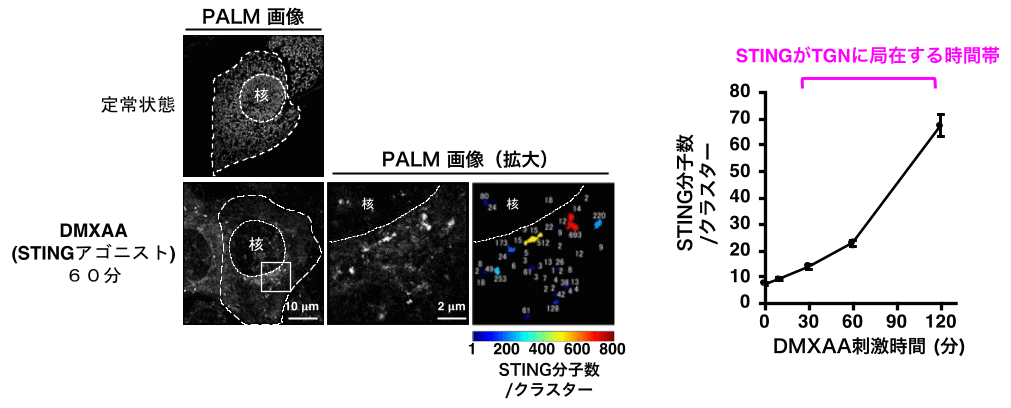
図2. STINGはTGN上でクラスターを形成する
STINGは定常状態において、細胞質全体に網目状に分布する小胞体に局在しています。DNAウイルスの感染等により刺激されるとSTINGは核近辺のゴルジ体に移動します。この際、PALMによりSTINGのクラスター形成を定量的に評価すると、STINGがTGNに局在する時間帯において、STINGクラスター内に含まれるSTING分子数が急激に上昇しました。
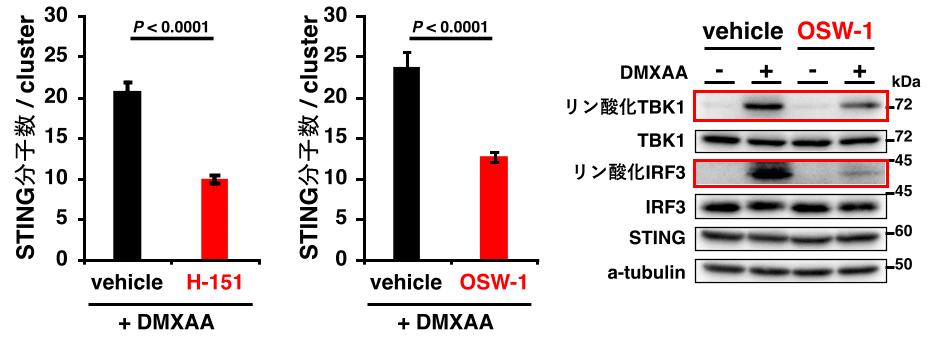
図3 STINGはパルミトイル化脂質修飾およびコレステロール依存的にクラスターを形成する
STING特異的パルミトイル化阻害剤H-151を処理すると、STINGのクラスター形成が抑制されました。OSW-1によりTGNへのコレステロール輸送を阻害すると、STINGのクラスター化が抑制されました。さらに、OSW-1処理により、STING経路が自然免疫シグナルを活性化するために必要なTBK1およびIRF3のリン酸化が抑制されました。
【謝辞】
JSPS科研費JP19H00974(基盤研究A)、JP21H02424(基盤研究B)、JP20K21387(挑戦的研究)、17939604(AMED-PRIME)、JPMJCR18H2(JST-CREST)、JPMJCR21E(JST-CREST)、国立がん研究センター研究開発費(2023-A-03)、三菱財団2020年度助成金(202012011)、2022年度武田科学振興財団研究助成、2023年度武田科学振興財団研究助成、日本学術振興会特別研究員助成(見目、高橋、朽津)
【用語説明】
注1. STING
Stimulator of interferon genesの略。小胞体に局在する4回膜貫通型タンパク質であり、細胞質DNAの出現に応答して自然免疫・炎症応答を惹起します。
注2. トランスゴルジネットワーク(trans-Golgi network:TGN)
ゴルジ体の最も外側に位置する槽(トランス槽)が成熟することによって形成される網目状の膜構造体。
注3. パルミトイル化脂質修飾
タンパク質翻訳後修飾の一種。タンパク質のシステイン残基にパルミチン酸がチオエステル結合で結合します。
注4. PALM
Photoactivated Localization Microscopyの略。蛍光体が蛍光を発するタイミングをずらすことで、単一分子レベルで蛍光体の位置情報を取得し、それらを重ね合わせて超解像画像を生成します。
注5. TBK1
TANK-binding kinase 1の略。自然免疫応答、炎症、オートファジー、細胞死など多様な細胞内シグナル伝達に関与するセリン・スレオニンキナーゼです。
注6. IRF3
Interferon regulatory factor 3の略。ウイルスに対する自然免疫系の反応において重要な役割を果たします。定常時には細胞質に存在し、ウイルス感染時には核内に移行して、I型インターフェロンをはじめとする抗ウイルス遺伝子の発現を誘導します。
【論文情報】
タイトル:Single-molecule localization microscopy reveals STING clustering at the trans-Golgi network through palmitoylation-dependent accumulation of cholesterol
著者:Haruka Kemmoku, Kanoko Takahashi, Kojiro Mukai, Toshiki Mori, Koichiro M. Hirosawa, Fumika Kiku, Yasunori Uchida, Yoshihiko Kuchitsu, Yu Nishioka, Masaaki Sawa, Takuma Kishimoto, Kazuma Tanaka, Yasunari Yokota, Hiroyuki Arai, Kenichi G.N. Suzuki*, Tomohiko Taguchi*
*責任著者:
東海国立大学機構 岐阜大学 糖鎖生命コア研究所 (iGCORE) 教授 鈴木健一
国立がん研究センター 研究所 先端バイオイメージング研究分野分野長 併任
東北大学大学院 生命科学研究科 教授 田口友彦
掲載誌:Nature Communications
DOI:10.1038/s41467-023-44317-5
URL:https://www.nature.com/articles/s41467-023-44317-5


.jpg)
-1.jpg)
_クレジット追加.jpg)
.jpg)




