新型コロナウイルスSARS-CoV-2から神経細胞死を抑制するペプチドを開発
アルツハイマー病治療戦略の応用に期待
概要
認知症の一つであるアルツハイマー病では、脳内の神経細胞が死ぬことによって、記憶障害や運動障害が起こるが、その原因の一つに「タウ」と呼ばれるタンパク質の蓄積がある。タウは本来、神経細胞内の細胞骨格である微小管の安定性の維持を担っているが、疾患脳では本来の機能を失い、凝集して蓄積してしまう。また、微小管親和性調節キナーゼ4 (MARK4(注1))がアルツハイマー病でタウの異常を引き起こすと考えられているが、そのMARK4を阻害することによってタウの蓄積を減少させ、毒性が緩和するとモデル動物で報告されている。したがって、MARK4の阻害剤はアルツハイマー病の治療薬となる可能性があり、注目されている。しかし、MARK4に似たキナーゼは多く、特異性の高い阻害剤の開発が求められている。
今回、東京都立大学理学研究科の大場俊弥大学院生、斎藤太郎助教、安藤香奈絵准教授らは、新たなMARK4の活性阻害ペプチドTAT-Orf9b¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵(Orf9bの10から18番目のアミノ酸と78から95番目のアミノ酸を繋いだペプチド)を開発した。Orf9bは新型コロナウイルス(SARS-CoV-2)のタンパク質の一つで、MARK4と結合させると、その活性を阻害することがわかった。そこで、人工合成できるように最小限の配列を同定し、さらに細胞内に取り込まれるように細胞膜透過ペプチド(TAT(注2))を付加したペプチドのTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を作成した。このペプチドを培養神経細胞の培地に加えると、MARK4の活性が阻害された。一方、よく似たキナーゼであるMARK2の活性は阻害しなかったことから、TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ はMARK4に特異性が高いことがわかった。さらに、アルツハイマー病のモデル動物(ショウジョウバエ)にTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を経口投与したところ、タウによる神経細胞死が抑制された。
本研究によって作成されたMARK4に対する特異的な活性阻害ペプチド(TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ )の応用により、将来、MARK4を標的としたアルツハイマー病の治療法の開発につながる可能性がある。
本研究の成果は、10月24日付けでNeurobiology of Disease誌に掲載された。
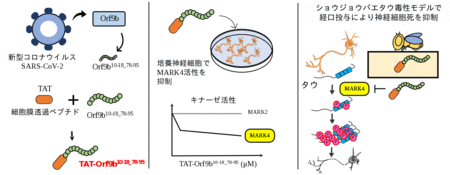 図1. 本研究の概要。新たなMARK4阻害ペプチドによってタウによる神経細胞死を抑制
図1. 本研究の概要。新たなMARK4阻害ペプチドによってタウによる神経細胞死を抑制
ポイント
■新型コロナウイルスのタンパク質の一つOrf9bは、アルツハイマー病関連キナーゼMARK4の活性を非競合的に阻害する。
■Orf9bの配列から、細胞膜透過性MARK4阻害ペプチドTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を作成した。
■TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、培養神経細胞に取り込まれMARK4の活性を抑制した。
■TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ をショウジョウバエタウ毒性モデルに経口投与すると、タウによる神経細胞死が抑制された。
研究の背景
微小管結合タンパク質タウは、アルツハイマー病などの神経変性疾患脳で蓄積し、神経細胞死を引き起こす。通常、タウは神経細胞の軸索で微小管の安定性を制御するが、疾患脳では過剰にリン酸化(注3)され、生理機能を失い凝集している。タウをリン酸化する酵素は多くあるが、その中でもMARK4は、疾患脳でその活性が上昇することや、その変異がアルツハイマー病リスクを増加させるなど、発症機構への関与が示唆されている。モデル動物では、MARK4の阻害によってタウによる神経細胞死を抑制できることが報告されており、MARK4の阻害は治療戦略として注目されている。
MARK4は多くの生物で重要な役割を担うPar-1ファミリーの一員で、哺乳類にはよく似たファミリーメンバーとしてMARK1,2,3,4がある。これまでに報告されているMARK4阻害剤は、基質と競合することでその活性を阻害するが、基質を認識する部位はファミリー分子の間でよく似ているため、MARK4以外のファミリーメンバーも阻害してしまう可能性があった。他のファミリー分子の生理機能を阻害せずにMARK4のみを阻害するという、MARK4への特異性の高い阻害剤が求められていた。
研究の詳細
本研究では、新型コロナウイルスの構成タンパク質の一つであるOrf9bが、MARKファミリーと相互作用することに注目し、Orf9bの配列から、MARK4を阻害するペプチドを開発した。Orf9bを哺乳類培養細胞に発現させて、MARK4の活性への影響をタウのリン酸化を指標として調べたところ、タウのリン酸化が阻害されることがわかった。次に、タウの毒性への影響を調べるため、ショウジョウバエモデルを用いた。ヒトのタウをショウジョウバエの視神経細胞に発現させると細胞死が起きるが、そこにOrf9bを共発現させると、タウのリン酸化が減少し、タウによる神経細胞死が抑制されていた。
Orf9bは全長97アミノ酸であり、全長を人工合成するのは難しい。合成しやすいようにできるだけ短くするため、MARK4の阻害に必要な最小限の領域を探した。構造予測ツールとOrf9bの機能的な情報から、Orf9bの10から18番目、78から95番目のアミノ酸を繋いだペプチド(Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ )を合成したところ、MARK4の活性阻害に十分であることを見い出した。
Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ のMARK4活性阻害パターンを調べると、濃度非依存的にMARK4の活性を阻害していたことから、Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、MARK4の基質認識部位と異なる領域に結合して立体構造を変化させるアロステリック阻害(注4)であることがわかった。アロステリック阻害剤は競合阻害剤より一般に特異性が高い。調べてみると、Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は同じファミリーメンバーのMARK2の活性は阻害せず、MARK4への特異性が高いことがわかった。
さらに、細胞外から加えられるよう、TATを付加したTAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を作成した。TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、培養神経細胞に取り込まれ、MARK4によるタウのリン酸化を阻害した。さらに、TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ を、ヒトのタウを発現するショウジョウバエに経口投与すると、TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は脳内に取り込まれ、視神経細胞に発現させたタウのリン酸化を抑制し、タウの毒性を緩和した。
研究の意義と波及効果
本研究で開発したMARK4の新たなペプチド阻害剤TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は、細胞膜を透過してMARK4の活性を阻害することで、タウの異常リン酸化を抑制し、タウによる神経細胞死を緩和した。さらに改良することでアルツハイマー病の治療薬の開発につながる可能性がある。またMARK4の異常な活性化は虚血による軸索損傷、炎症、心疾患、癌や糖尿病への関連も示唆されており、それらの疾患の治療にも役立つ可能性がある。
TAT-Orf9b ¹⁰⁻¹⁸₋⁷⁸⁻⁹⁵ は特許取得ずみ [The JP,2023-064002,A].
論文情報
<タイトル>
A cell-penetrating peptide derived from SARS-CoV-2 protein Orf9b allosterically inhibits MARK4 activity and mitigates tau toxicity.
<著者>
Toshiya Oba, Daiki Homma, Sophia Jobien M. Limlingan, Aoi Fukuchi, Akiko Asada, Taro Saito, and Kanae Ando
<雑誌名>
Neurobiology of Disease
<DOI>
10.1016/j.nbd.2023.106334
補足説明
注1)MARK4
Microtubule Affinity Regulating Kinase 4の略称であり、タンパク質をリン酸化する酵素である。アルツハイマー病のリスク遺伝子の一つとして同定されている。
注2)TAT
Transactivator of transcriptionの略称であり、エイズウイルスHIV由来。細胞膜を透過するペプチド(Cell-permeable peptide)の一つ。
注3)リン酸化
各種の生体高分子へのリン酸の共有結合による付加。タンパク質では翻訳後修飾の一つで、立体構造の変化によりその機能や特性を変化させる。
注4)アロステリック阻害
酵素の基質結合領域以外の部分に結合することで、酵素の構造を変化させ、基質の親和性を低下させる阻害。


.jpg)
-1.jpg)
_クレジット追加.jpg)
.jpg)




