アルツハイマー病とレビー小体型認知症の複合病態で神経細胞死が進行する
~モデルマウスを用いた解析による研究成果~
2025年8月1日
早稲田大学
アルツハイマー病とレビー小体型認知症の複合病態で神経細胞死が進行する ~モデルマウスを用いた解析による研究成果~
詳しくは、早稲田大学ウェブサイトをご確認ください。
| 【発表のポイント】 ●アルツハイマー病とレビー小体型認知症の複合した病態を、モデルマウスを用いて検証した。両疾患では、異なるタンパク質が神経細胞内に凝集して蓄積し、機能障害を起こして、最終的に細胞死に至るが、これまで蓄積するタンパク質であるタウタンパク質とα-シヌクレイン(以下シヌクレイン)を同時に神経細胞に過剰発現させ、マウス個体で検証した研究がなかった。
●それぞれの疾患のモデルマウスを掛け合わせダブルトランスジェニックを作り、単独のモデルマウスと比較した。その結果、タウ病変の悪化と神経細部死の進行、文脈記憶(※1)の障害の進行が、解析した8月齢で認められた。今回の研究により、ヒト疾患においても、両者の蓄積は病態を進行させる可能性を示唆した。 |
アルツハイマー病とレビー小体型認知症はともに認知症の原因疾患で、レビー小体型認知症は日本においては、アルツハイマー病についで2番目に患者数が多い。アルツハイマー病では神経細胞内にリン酸化されたタウタンパク質が、レビー小体型認知症ではリン酸化されたα-シヌクレイン(以下シヌクレイン)が凝集し蓄積することで、機能障害を起こし、やがて細胞死に至り、そのため、認知機能の障害が起こります。二つの病態は単独で起こることが多いですが、複合した病態が起きることも知られています。また、シヌクレインの蓄積が主に中脳のドーパミン産生神経細胞で起こり、細胞死が引き起こされるのがパーキンソン病です。
早稲田大学 理工学術院 大島登志男(おおしまとしお)教授らの研究グループでは、二つの疾患のモデルマウスを掛けあわせることで、ダブルトランスジェニックマウス(Double Tg)を作成し、タウタンパク質とシヌクレインタンパク質を神経細胞に過剰に発現させて、それぞれ単独のモデルマウスとの病態進行を8か月齢で比較しました。その結果、タウタンパク質のリン酸化の進行、脳内炎症の進行、神経細胞死の進行が観察されました。
本研究成果は2025年7月25日に「Molecular Neurobiology」に公開されました。
キーワード:
アルツハイマー病、レビー小体型認知症、モデルマウス、神経細胞死、認知機能障害
(1)これまでの研究で分かっていたこと
アルツハイマー病とレビー小体型認知症はともに認知症の原因疾患で、レビー小体型認知症は日本においては、アルツハイマー病についで2番目に患者数が多い。アルツハイマー病では神経細胞内にリン酸化されたタウタンパク質が、レビー小体型認知症ではリン酸化されたα-シヌクレイン(以下シヌクレイン)が凝集し蓄積することで、機能障害を起こし、やがて細胞死に至り、そのため、認知機能の障害が起こります。二つの病態は単独で起こることが多いですが、複合した病態が起きることも知られています。また、シヌクレインの蓄積が中脳のドーパミン産生神経細胞におもに起こり、細胞死が引き起こされるのがパーキンソン病です。
それぞれモデルマウスを用いた研究が行なわれてきました。アルツハイマー病ではアミロイドベータの蓄積を再現したモデルとタウタンパク質の蓄積を再現したモデルがあります。後者では、家族例でみられるアミノ酸置換で凝集性が高まることから、アミノ酸置換を導入したヒトタウタンパク質を神経細胞内に発現させたモデルマウスが開発され、研究に用いられてきました。レビー小体型認知症のモデルもアミノ酸置換によりシヌクレインの凝集性が高まるため、変異型シヌクレインを神経細胞に過剰に発現させたマウスモデルが研究に用いられています。近年、タウタンパク質やシヌクレインタンパク質の蓄積が神経細胞間で伝播する現象も報告されており、両疾患の間でも、タンパク質の凝集体を脳内に注入して、蓄積の相互作用を検討する研究が行なわれていますが、変異型タウタンパク質とシヌクレインタンパク質を神経細胞に過剰発現させたモデルマウスを用いた研究はありませんでした。
(2)新たに実現しようとしたこと、明らかになったこと
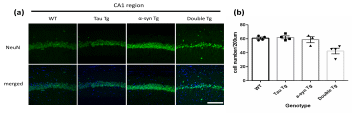
本研究では、アルツハイマー病とレビー小体型認知症のモデルマウスとして広く用いられている系統を使用しました。アルツハイマー病のマウスモデルは、前述の様にアミロイド病変を主体としたものとタウ病変を主体としたものに大別されますが、今回はタウ病変を主体としたもので、P301S変異(301番目のアミノ酸がプロリンがセリンへ変異)を有するPS19ライン(Tau Tg, Yoshiyama et al., 2007)を用いました。レビー小体型認知症のマウスモデルとしては、シヌクレインのA53T(53番目のアミノ酸のアラニンがトレオニンへ変異)変異を有するもので(α-syn Tg, Lee et al., 2002)、変異型シヌクレインが中枢神経系に広く発現しており、最初の報告ではパーキンソン病モデルとされているが、レビー小体型認知症のマウスモデルとして用いました。これらのモデルマウスを掛けあわせて、2重トランスジェニックマウス(Double Tg)を作成し、Tau Tg及び-syn Tgとの比較において、8か月齢におけるリン酸化タウ、リン酸化-シヌクレイン、神経炎症、神経細胞数、について、海馬を組織学的に解析しました。また、行動解析として、5月齢と8月齢で恐怖条件付け文脈記憶におけるすくみ時間(freezing time) ※1を比較しました。その結果、海馬のCA1領域において、リン酸化タウの増加と、神経炎症の進行、神経細胞数減少の悪化が確認されました(図1)。また、恐怖条件付け文脈記憶におけるfreezing timeがDouble Tgにおいて短縮しており、文脈記憶の低下が示唆されました(図2)。
※ 海馬CA1領域の神経細胞をマーカーのNeuNで染色した脳組織の画像(a)と、陽性細胞数をカウントし、野生 型(WT)、タウTg(TauTg)、シヌクレインTg(α-syn Tg) 、Double Tgで比較した(b)。その結果、Double Tgは単独のTgより神経細胞数の減少が統計的有意に認められた。
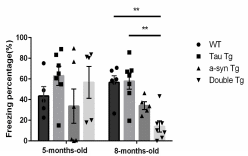
図2 恐怖条件付け文脈記憶におけるすくみ時間(freezing time)の比較
※ 8か月齢において、Double Tgにおいては、freezing timeがWTとTau Tgに比べて短縮していた(p<0.01)。
(3)研究の波及効果や社会的影響
今回の研究で、アルツハイマー病とレビー小体型認知症の複合病態は、単独の場合より速く病態が進行する可能性を示唆しています。両疾患は、認知症の原因として注目されており、神経細胞内に異常なタンパク質の凝集が起きて、機能障害さらには細胞死へとつながります。今回の研究は、凝集や蓄積のメカニズムを解明する上で、今後の研究の発展に寄与する知見と考えます。
(4)課題、今後の展望
タウとシヌクレインがどの様に神経細胞内で凝集し神経細胞の機能を障害させ、細胞死に至るか不明な点が多く、そのメカニズムを明らかにすることで、疾患治療につなげることが期待されます。我々の研究室では、アミロイドベータが神経細胞内のタウタンパク質をリン酸化し、凝集させる1つのメカニズムとして、CRMP2(コラプシン反応媒介タンパク質2)のリン酸化が関与する可能性を報告しました(Noguchi et al., 2025)。この研究では、CRMP2のリン酸化を抑制することで、タウタンパク質リン酸化が抑制されることを示しています。今後CRMP2のリン酸化を抑制する薬剤の効果を検討する予定であり、今回の複合的な病態の進行を抑制する効果があるかも検討したいと考えています。
(5)研究者のコメント
本研究チームでは、ヒト疾患の病態解明や治療法の開発を目指しています。今回、人口の高齢化に伴い、大きな社会問題になっている認知症の病態解明に関する研究で新たな知見を得ることが出来ましたが、これは今後の研究に向けた一歩目であり、今後さらに研究を発展させていきたいと考えています。
(6)用語解説
※1 恐怖条件付け文脈記憶におけるすくみ時間(freezing time)
マウスを所定の箱に入れ、電気ショックを与える。24時間後にマウスを同じ箱に入れると、マウスは箱に入れられることと電気ショックを与えられることを関連付けて記憶している。これを文脈記憶と呼ぶ。文脈記憶によりマウスは恐怖のためすくみ(freezing)行動を示す。5分間の観察のうちで、freezingを示した割合を比較することで、文脈記憶を評価する。この種の記憶が障害されると、freezing time (%)は低下する。
(7)論文情報
雑誌名:Molecular Neurobiology
論文名:Co-expression of mutant tau and α-synuclein in neurons promotes tau phosphorylation, neuronal loss and neuroinflammation in mouse brain
執筆者名(所属機関名):Yuki Yamamoto(早稲田大学)、Toshiki Kubota(早稲田大学)、Daisuke Noguchi(早稲田大学)、Takaomi C Saido(理化学研究所)、Toshio Ohshima(早稲田大学)*
掲載日時:2025年7月25日
掲載URL:https://pubmed.ncbi.nlm.nih.gov/40707862/
DOI:https://link.springer.com/article/10.1007/s12035-025-05248-y
*:責任著者
(8)研究助成
研究費名:科学研究費 基盤研究(C) 課題番号:22K06464
研究課題名:CRMP2リン酸化の神経回路形成および神経再生への役割解明とその応用
研究代表者名(所属機関名):大島 登志男(早稲田大学)


.jpg)
-1.jpg)
_クレジット追加.jpg)
.jpg)




