新たな脱アシル型クロスカップリング反応の開発に成功
-クロスカップリング反応に新たな”食材”と”レシピ”を提供 医薬品合成や材料科学への応用へ期待-
2024 年 7 月 30日
早稲田大学
新たな脱アシル型クロスカップリング反応の開発に成功
-クロスカップリング反応に新たな”食材”と”レシピ”を提供 医薬品合成や材料科学への応用へ期待-
詳細は早稲田大学HPをご覧ください。
発表のポイント
● 芳香族化合物の合成に有効なクロスカップリング反応※1の新たな手法を開発し、芳香族ケトンを多様な相手と反応させることに成功
● 一つの反応容器で全ての反応を行うワンポットプロセス※2により効率的な反応が実現
● 芳香族ケトンは様々な化合物の合成に利用でき、本研究成果により医薬品合成や材料科学における広範な応用が期待される
ノーベル化学賞を受賞した、2つの化合物を金属触媒によりつなげるクロスカップリング反応は、より広範な化合物に利用できる次世代型反応の開発が求められています。
早稲田大学理工学術院の山口潤一郎(やまぐち じゅんいちろう)教授の研究グループは、新しいクロスカップリング反応である「脱アシル型(ケトンを取り除き他の化合物に変換する)クロスカップリング反応」を開発し、基礎化学品である芳香族ケトンを多様な相手と反応させる手法を確立しました。この新手法により、従来の用いることができなかった芳香族ケトンがクロスカップリング反応に利用できるようになりました。ケトンを効率的にエステルへ変換したことが本反応の肝であり、研究グループが精力的に開発していたカップリング条件によりワンポットで多彩な脱アシル型反応を実現しました。医薬品合成や材料科学における応用が期待されます。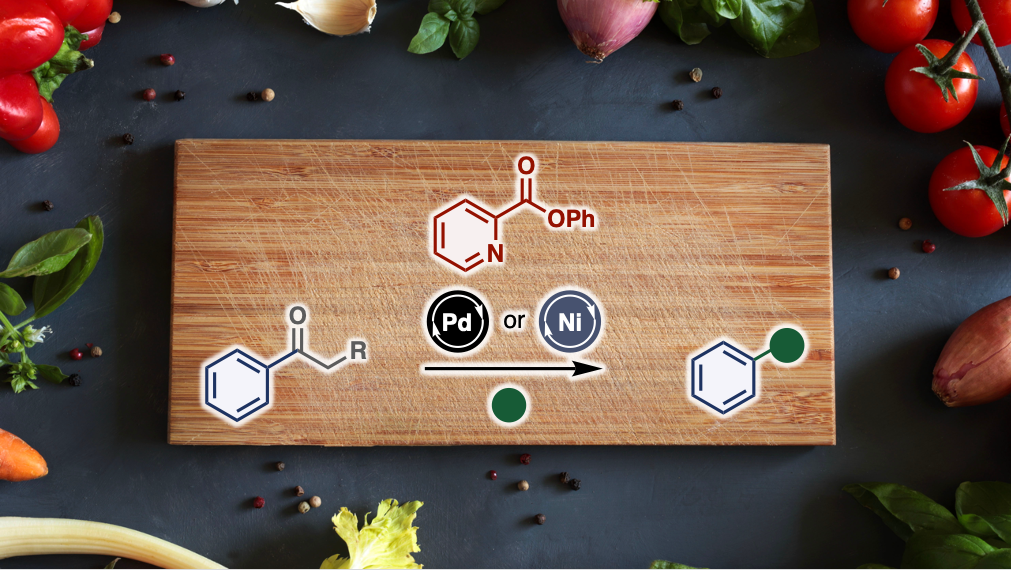
図1:本研究成果である芳香族ケトンのクロスカップリング反応
本研究成果は、Cell Press 社『Chem』のオンライン版に2024年7月29日(月)午前11時(現地時間)に掲載されました。
論文名:Versatile Deacylative Cross-coupling of Aromatic Ketones
(1)これまでの研究で分かっていたこと
ノーベル化学賞を受賞したクロスカップリング反応は、医農薬や有機電子材料の重要な役割を果たす芳香族化合物の合成に大変有効で、クロスカップリング法の進展により簡便かつ安価に合成できるようになりました。
これらの方法では、一般的に求電子剤と呼ばれる芳香族化合物に遷移金属触媒存在下で様々な化合物と反応させます。従来はそれらの芳香族化合物は、炭素―ハロゲン結合をもつハロアレーンのみでした。近年、炭素―酸素、炭素―窒素結合などをもつ芳香族化合物のクロスカップリング反応が開発されました。最近では、炭素―炭素結合をもつ、芳香族エステルや、アミド、ニトリルなどの化合物も利用できる次世代型クロスカップリング反応が開発されています。
しかし、この次世代型クロスカップリング反応の原料として、同じく炭素―炭素結合をもつ芳香族ケトンは学術的に最も挑戦的な芳香族化合物とされており、クロスカップリングに利用できる良い手法は報告されていませんでした。芳香族ケトンは様々な化合物の合成に利用できる基礎化学品であり、これらをクロスカップリング反応の反応剤として用いることができれば、既存の合成手法を一新できる可能性があり社会的にも求められていました。
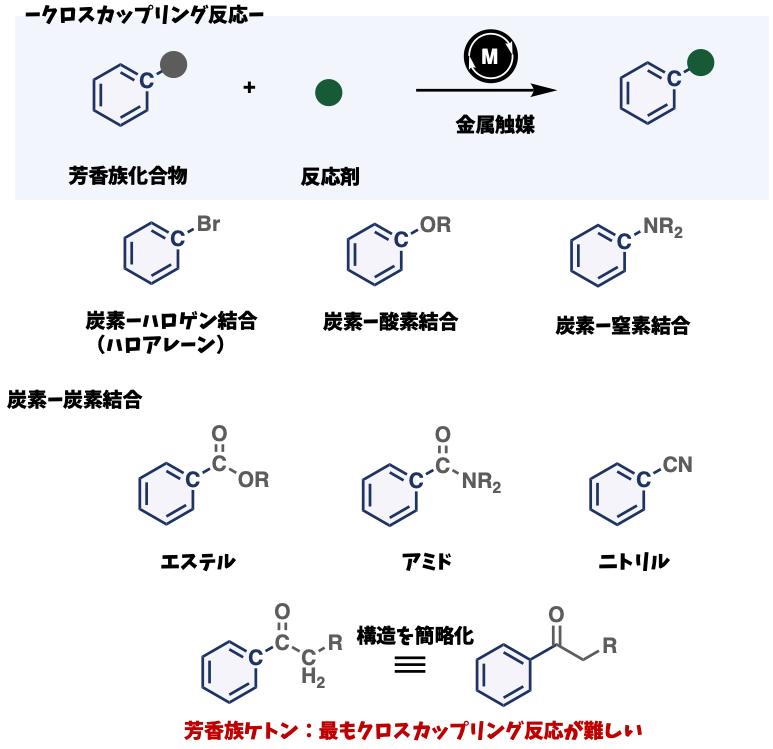 図2:クロスカップリング反応
図2:クロスカップリング反応
(2)今回新たに実現しようとしたこと、明らかになったこと、そのために新しく開発した手法
今回の研究では、芳香族ケトンをクライゼン縮合※3および逆クライゼン縮合※4という古典的な反応をうまく活用し芳香族エステルに変換し、これを多様な化合物と反応させるワンポットプロセスを開発しました。この手法により、結果的に、脱アシル型(ケトンを取り除き他の化合物に変換する)クロスカップリング反応の開発に成功しました。
研究の核となる手法は、ケトンをエステルに変換するプロセスにあります。具体的には、芳香族ケトンをクライゼン縮合によりエステル化し、その後、逆クライゼン縮合を行うことで、芳香族エステルを生成します。芳香族エステルは、次世代型クロスカップリング反応の進展のなかで、本研究グループを中心に、精力的に研究が進められ、独自のパラジウム触媒やニッケル触媒(主にパラジウム/ニッケルdcypt触媒)※5により、多彩な化合物と反応できることがわかっていました。したがって、この ①ケトンをエステルに変換するプロセスと ②エステルを他の化合物に変換するプロセスを組み合わせることにより、困難な脱アシル型カップリングを実現できると考えました。しかし、①のプロセスを化学選択的に進行させることができなければ、混合物しか得られません。今回、フェニルピコリン酸エステルという化合物を用いることで、高い収率でいろいろなケトンをフェニルエステルに変換できることを新しく発見しました。
しかし、②のプロセスにつなげる段階で1つ問題が生じました。①の反応での副生成物が、②のプロセスを阻害することがわかったのです。そこで、本研究グループは、①のプロセス終了後、安価な酢酸亜鉛を加えたところ、副生成物は溶媒に溶けない化合物へと変化し、②のプロセスが効率的に進行することを見つけました。結果的に、パラジウム触媒やニッケル触媒をつかって、7つの相手(反応剤)と反応させることに成功し、多彩な反応剤との脱アシル型カップリング反応の開発に成功しました。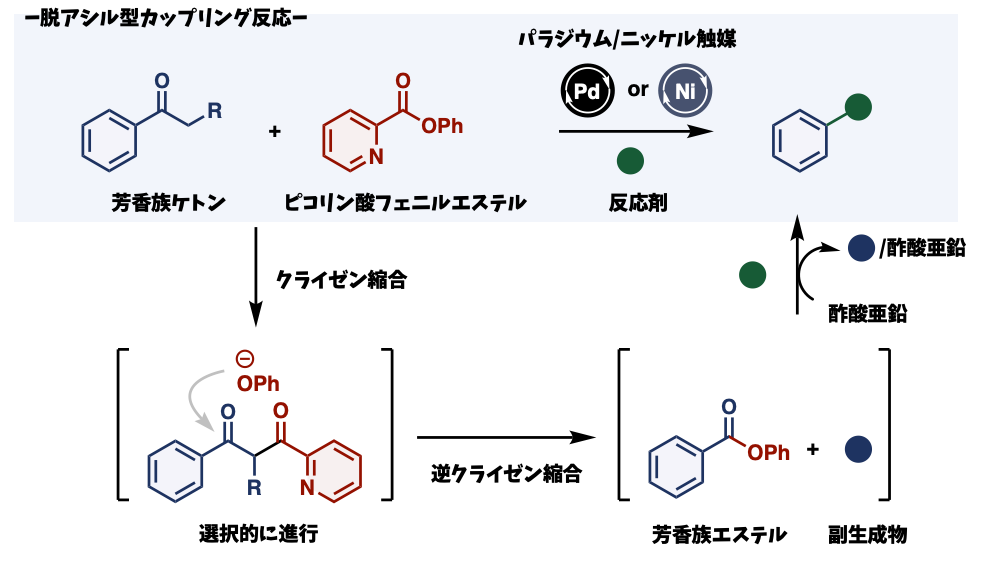
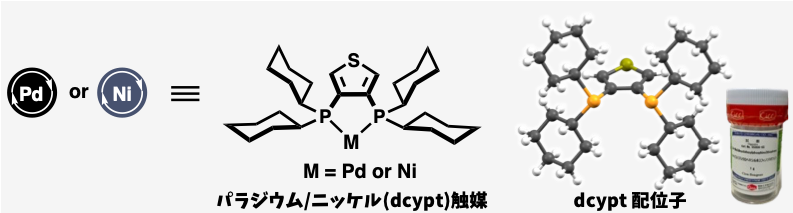 図3:本研究で開発した脱アシル型クロスカップリング反応
図3:本研究で開発した脱アシル型クロスカップリング反応
(3)研究の波及効果や社会的影響
本研究成果は、医薬品合成や材料科学などの広範な分野において応用が期待されます。これまで、脱アシル型カップリング反応はありましたが、一般的な芳香族化合物に、様々な相手を一工程で反応させるものはありませんでした。これを変換できるようになったため、様々な化合物の合成方法論を一新できる発見になると考えられます。
(4)今後の課題
今回はワンポットプロセスにより、困難であった脱アシル化反応を実現しましたが、ケトンをより直接変換できる触媒の開発はより高難度です。環境負荷を考慮すると副生成物を生じない方法も求められます。また、このケトンをエステルにする手法は収率をよく進行させるためには現在150度の高温が必要であり、より低温で進行する手法の開発も進めています。
(5)研究者のコメント
「この成果は、早稲田大学に着任前後から、私たちの研究グループが長年取り組んできた努力の結晶です。ようやくラスボスである芳香族ケトンの攻略に成功しました。例えるなら、クロスカップリング反応に新たな”食材”と新しい”レシピ”を提供したこととなります。今後は、新しい触媒の開発により、化学反応の効率を大幅に向上させ、多くの分野での応用を期待したいと思います。」(山口潤一郎教授)
(6)用語解説
※1 クロスカップリング反応
2010年にノーベル化学賞を受賞した技術。一般的には、パラジウム触媒を用いて、ハロゲンを含む化合物と有機金属試薬や反応剤を混ぜ合わせ、それらを結合させて一つの分子にする手法を指す。この反応により、さまざまな有機化合物の合成が可能となり、医薬品、農薬、材料科学などの分野で広く利用されている。
※2 ワンポットプロセス
ワンポットプロセスとは、一つの反応容器(フラスコや反応釜)に複数の試薬を順次加えていくことで、複数の化学反応を連続的に行う工程を指します。例えば、複数の反応を別々の容器で行う場合、それぞれの反応の停止処理や生成物の抽出・分離が必要となり、工業的には高コストがかかる。一方、ワンポットプロセスでは、一つの反応容器で全ての反応を行うため、コスト削減、処理の簡便化、生成物の収率向上など、多くの利点がある。
※3 クライゼン縮合
2つのエステルまたは1つのエステルと1つのケトンが反応してβ-ケトエステルまたはβ-ジケトンを生成する反応。
※4 逆クライゼン縮合
クライゼン縮合の逆反応で、β-ケトエステルまたはβ-ジケトンを2つのエステルまたは1つのエステルと1つのケトンに分解する反応。
※5 パラジウム/ニッケルdcypt触媒
エステルを取り除き他の化合物に変換できる触媒。山口グループで独自に開発された新規ジホスフィン配位子dcypt (3,4-ビス(ジシクロヘキシルホスフィノ)チオフェン)をもつパラジウム・ニッケル化合物。なお、dcyptに関しては関東化学から発売中(製品番号05806)。
(7)論文情報
雑誌名:Chem
論文名:Versatile Deacylative Cross-coupling of Aromatic Ketones
執筆者名:中原輝、一色遼大、久保真之、飯泉慶一朗、武藤慶、山口潤一郎(早稲田大学)
掲載予定日時(現地時間):2024年7月29日 午前11時
掲載予定日時(日本時間):2024年7月30日 午前1時
掲載予定URL:https://doi.org/10.1016/j.chempr.2024.07.002
(8)研究助成
研究費名:JSPS科研費 JP21H05213
研究課題名:新規触媒による高効率脱アシル化クロスカップリング反応の開発
研究代表者名(所属機関名):山口潤一郎(早稲田大学)
その他、JST ERATO JPMJER1901も一部ご支援をいただきました。


.jpg)
-1.jpg)
_クレジット追加.jpg)
.jpg)




