イネコムギはイネのミトコンドリアを持つ新たなコムギであった!
~世界初!コムギにイネの遺伝子資源の導入に成功~
1.概要
コムギとイネは世界の主要作物ですが、異なる亜科に属していることから交雑することができず(交雑不全1)、それらが持つ優良遺伝資源を相互に利用することはできませんでした。
東京都立大学大学院理学研究科のTety Maryenti(当時・大学院生、現・インドネシア大 助教)、恩田乃々佳(大学院生)、岡本龍史 教授、鳥取大学国際乾燥地研究教育機構・乾燥地研究センターの石井孝佳 准教授、国立遺伝学研究所の越水静 助教らは、先行研究により作出されたコムギとイネの交雑植物(イネコムギ)(2021年10月発表)のゲノム解析を行い、イネコムギがイネのミトコンドリアをもつ細胞質雑種コムギであることを明らかにしました。
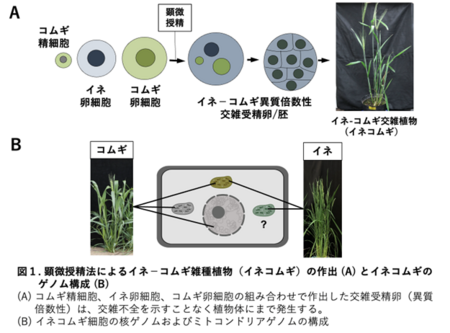
今回の研究では、図1Aのように、コムギおよびイネの花から単離した配偶子(卵細胞と精細胞)を任意の組み合わせで顕微授精法2により融合させることで、イネとコムギの交雑植物(イネコムギ,oryzaWheat)を作出し、それらのゲノムの配列と組成を決定しました。その結果、イネコムギは、コムギゲノムに加えて、イネとコムギのミトコンドリアゲノムを持つ細胞質雑種3コムギ(Cybridコムギ)であることが示されました。(図1B)。また、ゲノム解析を行った1個体では、イネの核ゲノムがコムギの核ゲノムの中に一部残ったイネコムギも確認することができました。しかし、このイネコムギがキメラ4であったため、次世代へのイネゲノムの伝達は確認できませんでした。これらの結果は、コムギにイネの遺伝子資源を導入できたことを世界で初めて示したものであり、顕微授精法による交雑植物(イネコムギなど)の作出手法は新たな育種技術としても期待されます。
2.ポイント
・顕微授精法を用いることによって、コムギとイネの生殖的隔離を打破することが可能になった。
・顕微授精法により作出したイネ-コムギ交雑植物(イネコムギ、oryzaWheat)のゲノム配列および組成の
解析に成功した。
・イネコムギは核ゲノムとしてコムギゲノムを、ミトコンドリアゲノムとしてコムギゲノムに加えてイネゲ
ノムを持つことが示された。
・ミトコンドリアは乾燥、低温、病原菌感染などの環境変化、ストレスを察知するセンサーとして機能して
おり、イネコムギはコムギが有していない新奇形質を獲得している可能性が高い。
3.研究の背景
三大穀物5であるコムギ、イネ、トウモロコシは世界の穀物生産の約9割を占めていますが、その理由として、これら作物の農業上の遺伝的特性が他の植物に比べて特に秀でていることが挙げられます。一方で、これら3種の作物はすべてイネ科植物ですが、異なる亜科に属していることから交配による交雑が非常に困難であり、それらがもつ優れた遺伝資源を相互に利用することは出来ませんでした。さらに、近年の気候変動や人口増加に目を向けると、乾燥・高温化によりコムギの輸出大国であったオーストラリアがコムギ輸入国に転じ、また、中進国・発展途上国などでは人口増・食生活変化によって穀物需要が著しく増加しており、人類の食料生産はこれまでにない危機に直面しているといっても過言ではありません。それゆえ、各々の優れた遺伝資源を相互利用するために、コムギ、イネ、トウモロコシなどの間の交雑不全を乗り越え、新たな交雑植物を作出する技術の確立が求められていました。
私達のグループでは、近年、顕微授精法を用いることによりコムギ−イネ間の交雑不全を克服し、イネの遺伝資源を保持する可能性が高いコムギ雑種(イネコムギ、oryzaWheat)の作出に成功しました(参考:https://www.tmu.ac.jp/news/topics/31308.html、および、 https://www.youtube.com/watch?v=DuEwYC6p-KI)。今回はこのイネコムギのゲノム組成を、各種ゲノム解析およびFISH解析6などにより明らかにしました。
4.研究の詳細
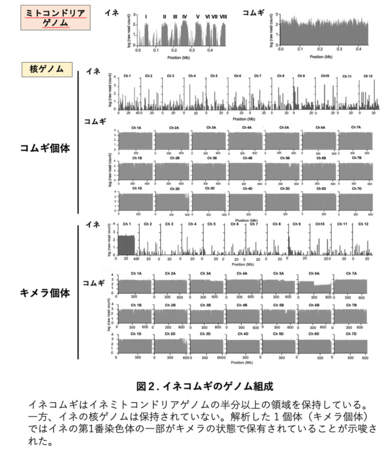
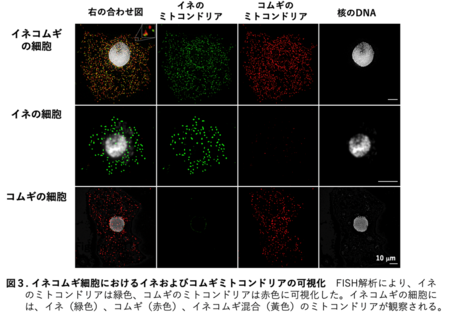
「イネ卵細胞、コムギ卵細胞、コムギ精細胞」および「イネ卵細胞、イネ精細胞、コムギ卵細胞、コムギ精細胞」を融合させた交雑受精卵を発生、・再分化させることで、7系統のイネコムギ植物体を作出しました(図1A)。これらの植物体から調製したゲノムDNAの塩基配列決定(ゲノム解析)を行った後、イネおよびコムギのゲノム配列情報を参照してイネコムギのゲノム配列の組成を調べたところ、解析した7系統のイネコムギのうちの6系統において、コムギの核・細胞質ゲノム配列に加えて、イネミトコンドリアのゲノム配列が保持されていることが示されました(図2中のミトコンドリアゲノム、および核ゲノム:コムギ個体)。さらに、残りの1系統では、イネの核ゲノム配列がコムギのゲノム配列の中に一部残ったイネコムギも確認することが出来ました(図2中の核ゲノム:キメラ個体)。しかし、このイネコムギがキメラであったため次世代へのイネ核ゲノムの伝達は確認できませんでした。また、イネコムギのF2世代個体から調製したゲノムDNAの詳細なゲノム配列の組成を解析することよって、イネミトコンドリアDNAに由来するDNA領域がコムギミトコンドリアゲノム内に挿入されていることが示されました。さらに、イネとコムギのミトコンドリア特異的なFISHプローブを作成し、イネコムギ細胞に対してFISH解析を行ったところ、イネミトコンドリア、コムギミトコンドリア、および融合ミトコンドリアが細胞内に観察されました(図3)。加えて、イネコムギがもつイネミトコンドリアゲノムの子世代(F2世代)および孫世代(F3世代)への伝達をゲノムPCR7により確認したところ、多くのイネミトコンドリア領域が安定的に世代を超えて伝達されていることも確認されました(図4)。
5.研究の意義と波及効果
顕微授精法により作出されたイネコムギのゲノム解析により、イネコムギは核ゲノムとしてはコムギゲノムを、ミトコンドリアゲノムとしてはコムギに加えてイネゲノムを持つこと、すなわち、イネコムギはイネのミトコンドリアをもつ新たなコムギ(細胞質雑種コムギ・Cybridコムギ)であることが明らかにされました。この成果は、世界で初めてコムギにイネの遺伝子資源を導入できたことを示したものです。
植物ではミトコンドリアなどが環境変化に対するセンサーとして働いている可能性が強く示唆されており、乾燥、低温、病原菌などの非生物的および生物学的ストレスに対する適応・耐性能はミトコンドリアを含む細胞質の機能に依存しています。このことから、イネのミトコンドリアを有するイネコムギは、コムギが有していない新たな形質(新奇形質)を獲得している可能性が高いと考えられ、現在イネコムギの形質評価が鋭意進められています。
今回、コムギとイネの遺伝資源の相互利用が可能であることが示され、新たな優良形質をもつ新作物の作出に繋がるプラットフォームとなることが期待されます。また、顕微授精法は配偶子の単離が可能な植物種に適応可能であることから、コムギとイネだけにとどまらず、トウモロコシ、パールミレット、ソルガム、サトウキビなどの多くの有用植物間の雑種植物の作出も視野に入ってきます。現在、我々の研究グループでは、トウモロコシコムギやパールミレットコムギの作出を進めています。
6. 論文情報
<タイトル>
Wheat cybrid plants, OryzaWheat, regenerated from wheat-rice hybrid zygotes via in vitro fertilization system possess wheat–rice hybrid mitochondria
<著者名>
Tety Maryenti, Shizuka Koshimizu, Nonoka Onda, Takayoshi Ishii, Kentaro Yano, Takashi Okamoto
<雑誌名>
Plant and Cell Physiology
<DOI>
DOI: 10.1093/pcp/pcae074
<公開日時>
2024年8月7日00:01 UTC(日本時間9:01)
7. 補足説明
[1] 交雑不全
種が異なると交配を行っても受精が生じない、あるいは、交雑胚が正常に発生しないことによって次世代の個体が得られないこと。特に亜科間および属間雑種などの遠縁の種間の交配(交雑)においては、ほとんど場合で交雑不全が生じる。
[2] 顕微授精(IVF)法
植物の花器官から卵細胞と精細胞をそれぞれ単離し、それら配偶子を電気的に融合させて受精卵を作出する手法。In vitro fertilization (IVF) 法ともいう。作出した受精卵を培養することで、植物体にまで発生・再分化させることができる。
[3] 細胞質雑種(Cybrid)
ミトコンドリアとプラスチドは独自のゲノムを保持する細胞質オルガネラである。細胞質雑種とは異種のミトコンドリアおよび/またはプラスチドを保持している状態のことである。Cytoplasmic hybrid (Cybrid)ともいう。
[4] キメラ
同一個体の中に異なる遺伝情報を持つ細胞が混在している状態の個体のこと。
[5] 三大穀物
コムギ、イネおよびトウモロコシの3種のイネ科作物を指す。世界の穀物生産の94%をこれら3種の作物が占めている(2018年 FAO報告)。
[6] FISH解析
Fluorescence in situ hybridization解析の略称。蛍光物質をつけたプローブ(標的とするゲノム配列と相補的な塩基配列を有するDNA配列)を標的細胞中の染色体と結合させ、蛍光顕微鏡下で目的の染色体部位を可視化する解析手法。
[7] ゲノムPCR
ゲノムDNA(鋳型)およびDNAプライマーを用いてPCRを行うことで、目的のゲノム領域のDNAを増幅すること。これにより、鋳型として用いたゲノムDNA上における目的ゲノムDNA領域の有無が判定できる。



.jpg)
-1.jpg)
_クレジット追加.jpg)
.jpg)




